STUDENČAN M, HULÍKOVA M, PAVLÍKOVÁ J. Antifosfolipidový syndróm v pozadí závažných kardiovaskulárnych komplikácií u pacientov hospitalizovaných na kardiologickom oddelení. Cardiol 2004;13(6):359–364
STUDENCAN M, HULIKOVA M, PAVLIKOVA J. Antiphospholipid syndrome in the background of severe cardiovascular complications in patients hospitalised in the cardiology ward. Cardiol 2004;13(6):359–364
Trombofíliu možno jednoducho definovať ako sklon k tvorbe trombóz a trombembólií. Trombofilné stavy môžu byť vrodené alebo získané, avšak ich podrobnejšia analýza presahuje rámec tohto článku. K častejším získaným trombofilným stavom patrí antifosfolipidový syndróm (APS) (1).
APS je definovaný venóznou alebo arteriálnou trombózou, trombocytopéniou a/alebo opakovanými potratmi u žien, v spojení s dôkazom antifosfolipidových protilátok (APLA), pričom najčastejšie ide o antikardiolipínové protilátky (ACLA) a/alebo LA (lupus antikoagulans) protilátky (2). Riziko trombóz v prítomnosti ACLA je päťkrát väčšie ako v prítomnosti LA protilátok (3).
Z praktického hľadiska je vhodné rozdelenie podľa miesta manifestácie na trombembólie v arteriálnom riečisku a trombembólie prebehnuté v žilovom riečisku. Lokalizáciu trombózy zohľadňuje aj klasifikácia APS na typy I – VI (tabuľka 1). Všeobecne platí, že najčastejšou príčinou trombembolických komplikácií v arteriálnom systéme je ateroskleróza a väzba na hemokoagulačné odchýlky je tu relatívne menej tesná. Pri žilových trombózach majú najvýznamnejšiu úlohu práve odchýlky v hemokoagulačnom systéme (4). Táto všeobecná skúsenosť možno viedla k tomu, že v kardiológii, kde dominujú komplikácie zo strany arteriálneho systému, predovšetkým koronárna choroba srdca, sa v klinickej praxi veľmi málo ráta s inou ako aterosklerotickou etiológiou a antifosfolipidový syndróm je výrazne poddiagnostikovaný. Príčin arteriálnej oklúzie však môže byť oveľa viac a ich celkový prehľad je uvedený v tabuľke 2.
V našej vlastnej klinickej praxi sa stretávame so závažnými
kardiologickými komplikáciami (akútny infarkt
myokardu, pľúcna trombóza/trombembólia) aj u pacientov,
kde na základe zhodnotenia rizikového profilu, veku
a anamnézy pacienta nie je dôvod myslieť na prítomnosť
aterosklerózy. V niektorých prípadoch bol dokumentovaný
aj negatívny koronarografický nález. U takýchto
pacientov sme svoju pozornosť logicky upriamili na hemokoagulačné
parametre.
Cieľom našej práce bolo overiť hypotézu, že pri cielenom
vyšetrovaní klinicky vyselektovanej skupiny pacientov
nie je APS raritným ochorením. V práci sa nesnažíme
o presné stanovenie frekvencie výskytu APS
u kardiologických pacientov. Dve kazuistiky pacientov sú
uvedené pre ilustráciu, ako príklady s priaznivým
a nepriaznivým priebehom ochorenia.
Súbor a metodika
V sledovanom období desiatich mesiacov bolo na našom kardiologickom oddelení hospitalizovaných 1 320 pacientov, pričom 72 % z tohto počtu predstavovali akútne kardiologické príjmy. Medzi akútnymi stavmi dominovali poruchy srdcového rytmu (240 pacientov), nestabilná angína pektoris (143 pacientov), akútny infarkt myokardu (123 pacientov) a pacienti prijatí kvôli prejavom závažnej kardiálnej dekompenzácie (108 pacientov). Klinické podozrenie na prítomnosť APS sme vyslovili u 14 pacientov, pričom ich priemerný vek bol 56,2 ± 11,5 rokov. Všetci následne absolvovali podrobné hemokoagulačné vyšetrenie v regionálnom centre hemostázy a trombózy. Deviatim pacientom z nich sa zistila pozitivita APLA. U týchto pacientov sa pozitivita APLA opakovane potvrdila s odstupom 2 – 18 mesiacov. ACLA protilátky sa vyšetrovali ELISA metódou, LA protilátky koagulačnou metódou (STACLOT). Inú príčinu trombofílie sme nezistili, vylúčená bola porucha v inhibičnom systéme PC (proteín C), PS (proteín S), deficit AT (antitrombín), PAI (inhibítor aktivátora plazminogénu). Skupina pacientov s potvrdeným APS mala priemerný vek 52,7 ± 9 rokov. Prehľad vyšetrovaných pacientov, vrátane klinických súvislostí je prehľadne znázornený v tabuľke 3. Tabuľka 4 ilustruje hematologické parametre u pacientov s potvrdeným APS. Podrobnejšie budú opísaní pacienti 1 a 3, ako príklady nepriaznivého a priaznivého priebehu ochorenia.
Opis prípadu 1
Anamnéza. 38-ročná pacientka s 18-ročnou anamnézou
recidivujúcej flebotrombózy a recidivujúcej pľúcnej
embolizácie, dlhodobo pelentanizovaná. Dokumentovaný
foramen ovale patens.
Akútne hospitalizovaná (preložená zo spádovej nemocnice) na našej koronárnej jednotke pre asi trojtýždňovú anamnézu dýchavice s výrazne progredujúcim trendom a echograficky opísanou ťažkou pľúcnou hypertenziou a trombózou pravej vetvy artérie pulmonalis.
Stav pri prijatí. Pri vedomí, orientovaná, astenický habitus, pokojové mierne dyspnoe, cyanóza zmiešaného typu, mierne zvýšená jugulárna náplň, dýchanie vezikulárne bez vedľajších fenoménov, akcia srdca pravidelná, 80/min, zdvíhavý úder hrotu, systolický šelest 2/6 s maximom v 4. medzirebrí parasternálne obojstranne, fixné rozdvojenie druhej ozvy nad pľúcnicou. Abdomen-hepar zväčšený 3 – 4 cm, hmatná systolická pulzácia. Dolné končatiny bez opuchov, varixy pravého predkolenia, ulcus cruris v oblasti pravého členka. Periférne pulzácie hmatné. Krvný tlak 100/75 mmHg.
Niektoré z vyšetrení: EKG: sínusový rytmus, 78/min, os + 120s t., rsR V1, neg. T V1-V4. Obraz pravostranného preťaženia (obrázok 1).
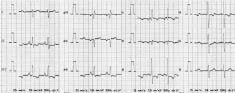
Obrázok 1 EKG záznam pacientky 1 pri prijatí na koronárnu jednotku
Figure 1 ECG of patient number1 on admission to coronary unit
Transezofageálne ECHOKG. Výrazná dilatácia pravých oddielov srdca, hypertrofia pravej komory, dopplerovské prejavy ťažkej pľúcnej hypertenzie (systolický tlak v arteria pulmonalis nad 140 mmHg), dilatácia kmeňa a vetiev artéria pulmonalis. V artéria pulmonalis od jej vetvenia smerom do pravej vetvy v celej vyšetriteľnej časti je prítomný rozsiahly cirkulárny trombus (obrázok 2). Spontánny echokontrast v celom vyšetriteľnom priebehu artérie pulmonalis. Viacpočetné nástenné tromby aj v dutine pravej predsiene, aj v ušku. Foramen ovale patens s bidirekcionálnym, prevažne pravo-ľavým skratom.
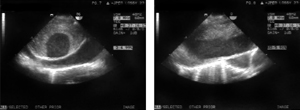
Obrázok 1 EKG záznam pacientky 1 pri prijatí na koronárnu jednotku
Figure 1 ECG of patient number1 on admission to coronary unit
RTG hrudníka. Výraznejšie híly bilaterálne. Z horných pólov oboch hílov vybiehajú nahor početnejšie pruhovité tiene, vpravo v oblasti hílu okrúhly tieň do priemeru 3,5 cm.
CT mediastína (bez kontrastu). Dilatácia oboch vetiev pľúcnice, šírka 3,6 cm. V pravom strednom poli je prítomný kalcifikát – tuberculom, napojený na pleuru. Trombus artérie pulmonalis nemožno oddiferencovať.
Hematologické vyšetrenie. Laboratórne parametre sú zdokumentované v tabuľke 5.
Hematologický záver. Známky DIC, konzumpčná koagulopatia, pozitívne markery poškodenia endotelu. Antifosfolipidový syndróm. Získaná APC rezistencia. Iná príčina trombofílie sa nezistila.
Medikamentózna liečba. Trandolapril 0,5 mg, nifedipín 10 mg, enoxaparín 3 x 0,6 ml s. c., tiklopidín 2 x 250 mg, warfarín 3,5 mg, prednizón 40 mg.
Priebeh hospitalizácie. Počas 10-dňového pobytu na koronárnej jednotke bola pacientka pri posteľovom režime ľahko dušná, stav bol stabilný, bez progresie. Zrealizované vyšetrenia potvrdili rozsiahlu trombózu artérie pulmonalis a taktiež prítomnosť trombov aj v pravej predsieni srdca. Extrémna pľúcna hypertenzia spôsobovala pravo-ľavý skrat cestou foramen ovale s ľahkou cyanotizáciou pacientky. Konzultovali sme kardiochirurga, ktorý po komplexnom zhodnotení stavu posúdil situáciu ako chirurgicky neriešiteľnú. Vzhľadom na chronicitu procesu, nevyhnutnosť kortikoterapie a intenzívnu antikoagulačnú liečbu sme upustili od zvažovanej trombolytickej liečby.
Po deväťdňovej hospitalizácii na koronárnej jednotke pacientku preložili na internú kliniku, kde po krátkodobom prechodnom zlepšení, napriek intenzívnej kombinovanej liečbe, došlo k progresii ochorenia, trombotizácii takmer všetkých ciev, rozvoju ARDS (aquired respiratory distress syndrome), hypertenzie, renálnej insuficiencie a úmrtiu za príznakov multiorgánového zlyhania.
Opis prípadu 3
Anamnéza a terajšie ochorenie. 48-ročná fertilná žena, nefajčiarka so štvorročnou anamnézou angíny pektoris, dvojročnou anamnézou arteriálnej hypertenzie, dokumentovanou cholelitiázou a hypertriglyceridémiou. Plazmatická hladina cholesterolu v norme. Akútne hospitalizovaná na našej koronárnej jednotke pre asi deväť hodín trvajúce typické stenokardie s čiastočným efektom na užitie NTG (nitroglycerín).
Na základe EKG (obrázok 3), plazmatickej hladiny kardiošpecifických enzýmov a ECHOKG sa stanovila diagnóza akútneho spodného infarktu myokardu.
A B
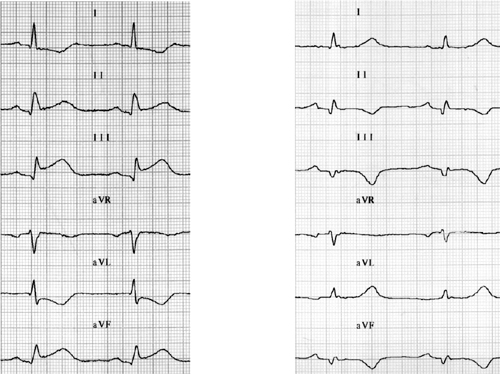
Obrázok 3 EKG pacientky 3 pri prijatí (A) a pri prepustení (B)
Figure 3 ECG of patient number 3 on admission (A) and at discharge (B)
Hospitalizačný priebeh. Prijatie. Systémová trombolýza streptokinázou (1,5 mil. j./h). Následná liečba: kyselina acetylsalicylová, nízkomolekulový heparín, nitrát, betablokátor, ACE inhibítor (enzým konvertujúci angiotenzín), analgetiká. 2. deň: Febrility do 39,2 °C. 2. – 3. deň: Recidíva pokojových stenokardií. 13. deň: Včasná bicyklová ergometria (EKG známky ischémie pri záťaži 75 W, pulzová frekvencia 135/min, sprievodná angína pektoris). 14. deň: Koronarografické vyšetrenie s nálezom trojcievneho koronárneho postihnutia. 15. deň: Otvorenie uzáveru pravej koronárnej tepny pomocou perkutánnej koronárnej angioplastiky + implantácie koronárneho stentu (obrázok 4). 19. deň: Emisia. Pacientka bez ťažkostí.
A B
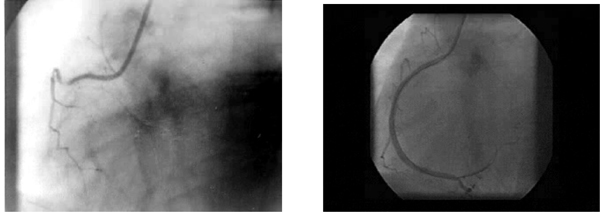
Obrázok 4 PTCA + implantácia stentu u pacientky s akútnym spodným infarktom myokardu a potvrdeným APS (pacientka 3) A. Koronarografia: Uzáver pravej koronárnej tepny v proximálnej tretine. B. Úspešné otvorenie cievy. V mieste pôvodného uzáveru je implantovaný nízko kontrastný stent Jostent
Figure 4 PTCA + stent implantation of patient with acute inferior myocardial infarction and confirmed APS (patient number 3). A. Coronarography: Right coronary artery closure in proximal one third. B. Successful vessel opening. In site of previous closure is implanted low contrast stent Jostent.
Odporúčaná ambulantná liečba. Kardiologická: Metoprolol 2 x 12,5 mg, trandolapril 2 mg/deň, fenofibrát 200 mg/deň. Hematologická: Kyselina acetylsalicylová 100 mg/deň, pentoxifylín 2 x 400 mg, klopidogrel 75 mg/deň, warfarín 3 mg/deň.
Klinické sledovanie. 20 mesiacov po prepustení bola pacientka bez subjektívnych ťažkostí, plne sa zapojila do práce vo svojej pôvodnej profesii. Kontrolné hematologické vyšetrenia dokumentovali pretrvávanie pozitivity ACLA. Do liečby bolo pridané antimalarikum Delagil.
Diskusia a záver
Antifosfolipidové protilátky (APLA) sú imunoglobulíny namierené proti negatívne nabitým fosfolipidom, alebo ich komplexom s makromolekulovou látkou – kofaktorom, najčastejšie bielkovinového charakteru. Príčina ich tvorby je komplexná a je dôsledkom poruchy imunitného dozoru. V systémoch krvného zrážania pôsobia na viacerých úrovniach, predovšetkým na endotel, PC, PS, primárnu hemostázu (6, 7). Mechanizmus vzniku trombózy nie je úplne jasný. Predpokladá sa interferencia APLA s a) uvoľ?ovaním endotelového prostacyklínu, b) aktiváciou antikoagulačných proteínov: systém PC, PS, AT, c) fosfolipidmi membrány krvných doštičiek, d) aktiváciou prekalikreínu na kalikreín, e) fibrinolytickým systémom: tPA,PAI-1 (8).
Vzhľadom na kardiologickú klinickú prax sú zaujímavé zistenia Mortona a spol. (9), ktorí uvádzajú, že viac ako 33 % pacientov s dokumentovanou oklúziou aortokoronárneho by-passu malo pred operáciou zvýšené hodnoty ACLA. Podľa iných štúdií možno zvýšené hodnoty ACLA dokumentovať až u 20 % pacientov s akútnym infarktom mladších ako 45 rokov. 61 % z týchto pacientov v ďalšom priebehu trpelo na trombembólie. Zdá sa, že ACLA sú dobrým indikátorom zýšeného rizika trombózy u pacientov po akútnom infarkte myokardu a indikáciou na profylaktickú antikoagulačnú, prípadne aj intenzívnu antiagregačnú liečbu. V prípadoch vzplanutia závažného katastrofického APS, alebo u pacientov s veľmi vysokými hladinami ACLA, možno nasadiť aj imunosupresívnu liečbu (cyklofosfamid) (10). Zvýšené ACLA možno dokumentovať aj u vysokého percenta mladých ľudí s restenózou po koronárnej angioplastike (PTCA) (11). U pacientov hospitalizovaných na internom a neurologickom pracovisku bola pozitivita ACLA detekovaná u 21 % z tých pacientov, kde bolo vyslovené klinické podozrenie na APS (12). U pacientov s trombooklúznymi komplikáciami APS môže riziko v?asných recidív dosiahnuť až 60 % (13).
Pre presnejšie stanovenie frekvencie výskytu APS u pacientov na kardiologickom oddelení by bolo potrebné realizovať náročné hematologické vyšetrenia u všetkých hospitalizovaných, ?o však technicky ani ekonomicky nie je možné. Naše skúsenosti ukazujú, že postup, pri ktorom sú potrebné hematologické vyšetrenia, sa realizuje len u pacientov s klinickým podozrením na APS a je efektívny. APS teda nie je v kardiologickej praxi raritným ochorením.V rutinnej starostlivosti o pacientov však dochádza k jeho podce?ovaniu a poddiagnostikovaniu. Potrebné je na? cielene myslieť a v prípadoch, kde aterosklerotický podklad komplikácií je neočakávaný (mladí pacienti, ženy pred menopauzou, pacienti bez rizikových faktorov ICHS, trombotické komplikácie v žilovom systéme...), indikovať u pacientov komplexné hematologické vyšetrenie. APS sa môže spolupodieľať na závažných kardiovaskulárnych komplikáciách, alebo môže byť ich jedinou príčinou.
Správna diagnóza APS a následná starostlivosť o pacientov si vyžadujú spoluprácu kardiológa a klinického hematológa s kvalitným laboratórnym zázemím. Jeho včasné podchytenie a adekvátna lie?ba môžu zabrániť recidívam kardiovaskulárnych komplikácií a pozitívne ovplyvniť kvalitu života pacientov.
Literatúra
1. Chrobák L, Dulíček P. Trombofilní stavy. Vnitř lék 1988;44:481–486.
2. Martini A, Ravelli A. The clinical significance of antiphospholipid antibodies. Ann Med 1997;29:159–163.
3. Bick RM, Kaplan H. Syndromes of thrombosis and hypercoagulability: congenital and acquired thrombophilias. Clin Appl Tromb Hemost 1998;4:25–50.
4. Gumulec M, Penka M, Radina M, et al. Diagnostika trombofilie arteriálního řečište. Hematológia a transfuziológia 1998;2–3:39–49.
5. Bick RL. Lupus antikoagulans anticardiolipin antibodies. Biomed Prog 1993;6:35.
6. Kubisz P. Diagnostika trombofilných stavov z pohľadu hematológa.Medicínsky monitor 1997;6:28–30.
7. Hulíkova M, Kubisz P. Antiphospholipid thrombosis syndrome.Haemostasis 2000;30(Suppl. 1):158.
8. Malý J, Pecka M, Malá H, et al. Effect of a modified diet on fibrinolytic capacity and fibrinolytic activity. Haemostasis 1988;28(Suppl. 2):A506.
9. Morton KT, Gavaghan S, Krilis G. Coronary artery bypass graft failure: An autoimmune phenomenon? Lancet 1986;I:1353.
10. Cervera R, Asherson RA, Rovenský J. Katastrofický antifosfolipidový syndróm. Lek listy 2003 I:11–14.
11. Baker WF, Bik RL. Antiphospholipid antibodies in coronary artery disease. Semin Thromb Hemost 1994;20:27.
12. Szilasiová J, Klímová E, Szilasiová A, et al. Neurologické prejavy u chorých s antifosfolipidovými protilátkami. Čes a slov Neurol Neurochir 2001;64/97:310–35.
13. Szilasiová A, Szilasiová J, Klímová E, et al. Antifosfolipidový syndróm a jeho interné a neurologické prejavy. Prakt lék 2002;82:187–190.ber 2004;II:133–134.